Nevjerojatna svojstva peptida. Sve o peptidima i kozmetici protiv starenja s peptidima Peptidi, metode njihove proizvodnje, peptidna veza
PEPTIDI- biopolimeri, čija je molekula građena od aminokiselinskih ostataka povezanih peptidnom vezom (-CO-NH-); U biokemiji se peptidima obično nazivaju niskomolekularni fragmenti proteinskih molekula koji se sastoje od malog broja aminokiselinskih ostataka (od dva do nekoliko desetaka). Mnogi P. imaju biol, aktivnost. Hidrolitičko cijepanje P. kataliziraju specifični enzimi - peptidne hidrolaze (vidi). Najzanimljivija i najvažnija skupina biološki aktivnih hormona su peptidni hormoni. To uključuje: hormone hipotalamusa: tireoliberin, gonadoliberin, somatostatin (vidi neurohormone hipotalamusa); hormoni hipofize: vazopresin (vidi), oksitocin (vidi), adrenokortikotropni hormon (vidi), lipotropin (vidi Lipotropni faktori hipofize); hormon štitnjače - kalcitonin (vidi); hormon gušterače - glukagon, (vidi); hormoni gol.-crijevni. trakta: sekretin (vidi), gastrin (vidi), pankreozimin, kao i angiotenzin (vidi), bradikinin i kalidin (vidi Medijatori alergijskih reakcija). Prirodni P. uključuju određene antibiotike (gramicidin C, itd.), ionofore (antamanid, itd.), inhibitore proteinaze, otrove zmija i insekata, kao i biološki aktivne di- i tripeptide: glutation (vidi), karnozin (vidi) i anserin (vidi), koji sudjeluje u mnogim biokemijskim procesima koji se odvijaju u stanici. Posebnu skupinu P. čine endogeni opijati (v. Endogeni opijati), te hormoni spavanja, stimulansi pamćenja i drugi tzv. neuropeptidi.
Gotovo svi biološki aktivni P., uključujući peptidne hormone, kinine (vidi), enkefaline itd., Sintetiziraju se u tijelu u obliku prekursora proteina, od kojih se formiraju kao rezultat specifične hidrolize određenih peptidnih veza pod utjecaj peptid -hidrolaze. P. obavljaju važnu funkciju u organizmu. Hipotalamički neurohormoni reguliraju aktivnost hipofize, koja kontrolira rad mnogih perifernih endokrinih žlijezda. P., koji imaju učinak sličan morfiju, utječu na mehanizme percepcije podražaja boli i druge procese koji se odvijaju u mozgu. Vazopresin, oksitocin, kortikotropin i melanotropin, osim svojih dobro poznatih učinaka, utječu na ponašanje, pamćenje, motivaciju i učenje. Peptidni hormoni otišli su u crijeva. trakta i hipotalamičkih neurohormona, osim u onim organima iz kojih su prvi put izolirani, pronađeni su u zamjetnim količinama u različitim strukturama mozga.
Chem. i biol, svojstva P. ovise o svojstvima peptidne veze i slijedu aminokiselinskih ostataka u molekuli peptida. U svakom P., s izuzetkom cikličkih, postoje aminski i karboksilni krajevi molekule (NH 2 - odnosno COOH krajevi). Općenito, P. struktura može se predstaviti na sljedeći način:
Gdje su R1, R2, R3, ..., Rn bočni radikali aminokiselinskih ostataka. Peptidna veza ima krutu strukturu, svi njeni atomi su u trans položaju i nalaze se u istoj ravnini. Najveće stupnjeve slobode nalaze veze koje se nalaze s obje strane alfa atoma ugljika, odnosno veze - C α -NH- i C α -CO-, oko kojih se cijeli peptidni lanac može okretati, što omogućuje polimeru prihvatiti različitu prostornu strukturu – konformaciju (vidi).
Ovisno o broju aminokiselinskih ostataka koji čine molekulu, peptidi se nazivaju di-, tri-, tetrapeptidi itd., oligopeptidi i polipeptidi. P.-ovo ime počinje imenom aminokiseline koja ima slobodnu a-NH2- skupinu, kojoj se dodaje nastavak -yl. Sufiks -il uključen je u naziv svih ostalih aminokiselinskih ostataka, s izuzetkom aminokiseline koja ima slobodnu COOH skupinu, naziv presjeka se ne mijenja. Na primjer, tripeptid NH 2 -Glu-His-Phen-COOH naziva se glutamil-histidil-fenilalanin.
P. su amfoterni elektroliti (vidi Amfoliti) i obično su visoko topljivi u vodi. Budući da su P. sposobni nositi električni naboj, različite metode kromatografije ionske izmjene (vidi) i elektroforeze (vidi), osobito visokonaponske elektroforeze, široko se koriste za preparativno odvajanje njihove smjese i pročišćavanje pojedinačnih P. Zbog prisutnosti asimetričnih a-ugljikovih atoma, polikarbonati imaju optičku aktivnost. Elektronski prijelazi peptidne veze određuju postojanje apsorpcijske trake P. u ultraljubičastom dijelu spektra na 180-230 nm, a prisutnost aromatskih aminokiselinskih ostataka u P. - triptofana, tirozina i fenilalanina - objašnjava prisutnost apsorpcijskog maksimuma u području od 280 nm. Određene kvantitativne metode za određivanje P temelje se na tim svojstvima. Rastezljive vibracije NH i CO grupa uzrokuju intenzivne apsorpcijske trake u infracrvenom dijelu spektra na 3300 cm -1, 3080 cm -1 i 1660 cm -1.
P. daju karakterističnu reakciju boje s ninhidrinom (vidi), koji se koristi za prikaz P. na papiru nakon particijske kromatografije ili elektroforeze. Postoje specifični reagensi koji stupaju u interakciju s N-terminalnom amino skupinom P., kao što su fenilizotiocijanat, dansil klorid, dinitrofluorobenzen itd., koji omogućuju identifikaciju N-terminalnog aminokiselinskog ostatka u P. Fenil izotiocijanat, osim toga , omogućuje sekvencijalno cijepanje aminokiselinskih ostataka od NH 2 - kraj P., itd. utvrditi njegovu primarnu strukturu (Edmanova metoda). Poznavanje strukture P. omogućuje njihovo sintetsko dobivanje i široku primjenu sintetskih fiziološki aktivnih P. u medu. praksi i eksperimentalnim istraživanjima.
Najjednostavnija kvalitativna reakcija na peptidnu vezu je biuretska reakcija (vidi). Značajnu poteškoću predstavlja kvantitativno određivanje biološki aktivnih P., budući da su prisutni u biolima, tekućinama i tkivima u zanemarivim količinama. Stoga se za kvantitativno određivanje pojedinačnih biološki aktivnih P. naširoko koriste radioimunološke metode (vidi), koje imaju visoku specifičnost i osjetljivost. Korištenjem radioimunoloških metoda dobiveni su gotovo svi podaci o promjenama koncentracije biološki aktivnih P. u ljudskoj krvi i tkivima u normalnim uvjetima iu različitim patološkim stanjima.
Bibliografija: Ashmarin I.P. i dr. Moždani oligopeptidi - analgetici, stimulansi pamćenja i sna, Molek. biol., vol. 12, br. 965, 1978, bibliogr.; Biokemija hormona i hormonska regulacija, ur. N. A. Yudaeva, str. 44, M., 1976; Dzveni T. i Gergey Y. Aminokiseline, peptidi i proteini, trans. s engleskog, M., 1976.; Leninger A. Biokemija, trans. s engleskog, M., 1976.; Schroeder E. i Luebke K. Peptides, trans. s engleskog, sv. 1-2, M., 1967.-1969.
1. Predmet i zadaci biološke kemije. Biokemija kao molekularna razina proučavanja strukturne organizacije, anabolizma i katabolizma žive tvari. Mjesto biokemije među ostalim biološkim disciplinama. Važnost biokemije u obrazovanju liječnika i za medicinu.
Biokemija je znanost o kemijskom sastavu žive tvari, kemijskim procesima koji se odvijaju u živim organizmima, kao io povezanosti tih transformacija s radom organa i tkiva. Dakle, biokemija se sastoji od tri dijela: 1) statička biokemija(ovo je analiza kemijskog sastava živih organizama); 2) dinamička biokemija(proučava ukupnost pretvorbe tvari i energije u tijelu); 3) funkcionalna biokemija(ispituje procese u pozadini različitih manifestacija života).
Glavni za biokemiju je razjasniti funkcionalnu, odnosno biološku svrhu svih kemijskih tvari i fizikalno-kemijskih procesa u živom organizmu, kao i mehanizam poremećaja tih funkcija kod raznih bolesti. Suvremena biokemija rješava sljedeće probleme: 1. Biotehnološki, t.j. stvaranje lijekova (hormoni, enzimi), regulatora rasta biljaka, proizvoda za suzbijanje štetočina, prehrambenih aditiva. 2. Provodi razvoj novih metoda i alata za dijagnostiku i liječenje nasljednih bolesti, karcinogeneze, prirode onkogena i onkoproteina. 3. Provodi razvoj metoda genetskog i staničnog inženjeringa za dobivanje temeljno novih pasmina životinja i biljnih oblika s vrjednijim svojstvima. 4. Proučava molekularne osnove pamćenja, psihe, bioenergije, prehrane i niz drugih zadataka.
Biološka kemija proučava molekularne procese koji su u osnovi razvoja i funkcioniranja organizama. Biokemija koristi metode “molekularnih” znanosti – kemije, fizikalne kemije, molekularne fizike, te je u tom pogledu sama biokemija molekularna znanost. Međutim, glavne krajnje zadaće biokemije leže u području biologije: ona proučava zakone biološkog, a ne kemijskog oblika kretanja tvari. S druge strane, “molekularni izumi” prirode, koje su otkrili biokemičari, nalaze primjenu u nebiološkim granama znanja i industriji (molekularna bionika, biotehnologija). U takvim slučajevima biokemija djeluje kao metoda, a predmet istraživanja i razvoja su problemi koji nadilaze biologiju.
Živi organizmi su u stalnoj i neraskidivoj vezi s okolišem. Ova veza se ostvaruje u procesu metabolizma. Metabolizam obuhvaća 3 faze: ulazak tvari u organizam, metabolizam i oslobađanje konačnih produkata iz organizma.
Unos tvari u tijelo događa se disanjem (kisik) i prehranom. U gastrointestinalnom traktu hrana se probavlja (razgrađuje na jednostavne tvari). Tijekom probave dolazi do hidrolize polimera (proteina, polisaharida i drugih složenih organskih tvari) u monomere, koji se apsorbiraju u krv i uključeni su u intermedijarni metabolizam.
Intermedijarni metabolizam (unutarstanični metabolizam) uključuje 2 vrste reakcija: katabolizam i anabolizam.
Katabolizam- proces razgradnje organskih molekula u konačne produkte. Krajnji produkti pretvorbi organskih tvari u životinja i ljudi su CO 2, H 2 O i urea. Procesi katabolizma uključuju metabolite koji nastaju tijekom probave i tijekom razgradnje strukturnih i funkcionalnih komponenti stanica.
Kataboličke reakcije praćene su oslobađanjem energije (egzergonske reakcije).
Anabolizam kombinira biosintetske procese u kojima se jednostavni građevni blokovi spajaju u složene makromolekule potrebne tijelu. Anaboličke reakcije koriste energiju koja se oslobađa tijekom katabolizma (endergonijske reakcije).
Gotovo svaka bolest počinje oštećenjem (poremećajem) jedne reakcije u staničnom metabolizmu, a zatim se širi na tkivo, organ i cijeli organizam. Metabolički poremećaji dovode do poremećaja homeostaze u biološkim tekućinama ljudskog tijela, što je popraćeno promjenama biokemijskih parametara.
Velika važnost kliničkih i biokemijskih metoda za proučavanje bioloških tekućina velika je u medicini i važna je za izobrazbu medicinskih laboratorijskih tehničara. Dovoljno je podsjetiti da se samo u ljudskoj krvi suvremenim metodama biokemijskih istraživanja može odrediti oko 1000 metaboličkih parametara.
Biokemijski pokazatelji bioloških medija ljudskog tijela naširoko se koriste u:
1. dijagnosticiranje bolesti, posebno diferencijalna dijagnoza;
2. odabir metode liječenja;
3. praćenje ispravnosti propisanog liječenja;
4. rezultati biokemijskih pretraga služe kao jedan od kriterija za izlječenje patološkog procesa;
5.screening (otkrivanje bolesti u pretkliničkoj fazi);
6.monitoring (praćenje tijeka bolesti i rezultata liječenja);
7. prognoza (podatak o mogućem ishodu bolesti).
2. Aminokiseline koje čine proteine, njihova struktura i svojstva. Peptidi.
Biološka uloga aminokiselina i peptida.
1. Opće strukturne značajke aminokiselina koje čine proteine
Zajedničko strukturno obilježje aminokiselina je prisutnost amino i karboksilnih skupina povezanih s istim α-ugljikovim atomom. R - aminokiselinski radikal - u najjednostavnijem slučaju predstavljen je atomom vodika (glicin), ali može imati složeniju strukturu. U vodenim otopinama neutralne pH vrijednosti aminokiseline postoje u obliku bipolarnih iona. Za razliku od 19 drugih α-aminokiselina, prolin je iminokiselina, čiji je radikal vezan i za β-ugljikov atom i za amino skupinu, zbog čega molekula dobiva cikličku strukturu.
19 od 20 aminokiselina sadrži asimetrični ugljikov atom u α-položaju, na koji su povezane 4 različite supstituentske skupine. Zbog toga se ove aminokiseline u prirodi mogu naći u dva različita izomerna oblika - L i D. Iznimka je glicin, koji nema asimetrični β-ugljikov atom, budući da je njegov radikal predstavljen samo atomom vodika. Proteini sadrže samo L-izomere aminokiselina.
Čisti L- ili D-stereoizomeri mogu se tijekom dugog vremenskog razdoblja spontano i neenzimski pretvoriti u ekvimolarnu smjesu L- i D-izomera. Taj se proces naziva racemizacija. Racemizacija svake L-aminokiseline na određenoj temperaturi događa se određenom brzinom. Svih 20 aminokiselina u ljudskom tijelu razlikuju se u strukturi, veličini i fizičko-kemijskim svojstvima radikala vezanih na α-ugljikov atom.
2. Podjela aminokiselina prema kemijskoj strukturi radikala
Prema kemijskoj strukturi aminokiseline se mogu podijeliti na alifatske, aromatske i heterocikličke.
Alifatski radikali mogu sadržavati funkcionalne skupine koje im daju specifična svojstva: karboksilne (-COOH), amino (-NH2), tiolne (-SH), amidne (-CO-NH2), hidroksilne (-OH) i gvanidinske skupine.
Za pisanje aminokiselinskih ostataka u molekulama peptida i proteina koriste se troslovne kratice njihovih trivijalnih naziva, au nekim slučajevima i jednoslovni simboli
3. Podjela aminokiselina prema topljivosti njihovih radikala u vodi
Svih 20 aminokiselina u proteinima ljudskog tijela mogu se grupirati prema sposobnosti njihovih radikala da se otope u vodi. Radikali se mogu poredati u kontinuirani niz, počevši od potpuno hidrofobnih i završavajući s jako hidrofilnim.
Topljivost radikala aminokiselina određena je polaritetom funkcionalnih skupina koje čine molekulu (polarne skupine privlače vodu, nepolarne skupine je odbijaju).
Aminokiseline s nepolarnim radikalima
Nepolarni (hidrofobni) radikali uključuju radikale koji imaju alifatske ugljikovodične lance (radikali alanina, valina, leucina, izoleucina, prolina i metionina) i aromatske prstenove (radikali fenilalanina i triptofana). Radikali takvih aminokiselina u vodi teže jedni drugima ili drugim hidrofobnim molekulama, zbog čega im se smanjuje površina kontakta s vodom.
Aminokiseline s polarnim nenabijenim radikalima
Radikali ovih aminokiselina bolje su topljivi u vodi od hidrofobnih radikala, budući da sadrže polarne funkcionalne skupine koje s vodom stvaraju vodikove veze. Tu spadaju serije, treonin i tirozin, koji imaju hidroksilne skupine, asparagin i glutamin, koji sadrže amidne skupine, te cistein sa svojom tiolnom skupinom.
Aminokiseline s polarnim negativno nabijenim radikalima
Ova skupina uključuje asparaginsku i glutaminsku aminokiselinu, koje imaju dodatnu karboksilnu skupinu u radikalu, koja disocira pri pH od oko 7,0 da nastane COO - i H +. Stoga su radikali ovih aminokiselina anioni. Ionizirani oblici glutaminske i asparaginske kiseline nazivaju se glutamat odnosno aspartat.
Aminokiseline s polarnim pozitivno nabijenim radikalima
Lizin i arginin imaju dodatnu pozitivno nabijenu skupinu u radikalu. U lizinu, druga amino skupina, sposobna vezati H +, nalazi se u β-položaju alifatskog lanca, au argininu, gvanidinska skupina dobiva pozitivan naboj, stoga histidin sadrži slabo ioniziranu imidazolnu skupinu , s fiziološkim fluktuacijama pH vrijednosti (od 6,9 do 7,4) histidin se nabije ili neutralno ili pozitivno. S povećanjem broja protona u mediju, imidazolna skupina histidina može vezati proton, stječući pozitivan naboj, a s povećanjem koncentracije hidroksilnih skupina, može donirati proton, gubeći pozitivan naboj. radikalnog. Pozitivno nabijeni radikali su kationi. Najveću topljivost u vodi imaju polarni nabijeni radikali aminokiselina.
4. Promjena ukupnog naboja aminokiselina ovisno o pH okoliša
Pri neutralnim pH vrijednostima, sve kisele (sposobne donirati H +) i sve bazične (sposobne dodati H +) funkcionalne skupine su u disociranom stanju.
Stoga, u neutralnom okruženju, aminokiseline koje sadrže nedisocijacijski radikal imaju ukupni naboj nula. Aminokiseline koje sadrže kisele funkcionalne skupine imaju neto negativan naboj, dok aminokiseline koje sadrže bazične funkcionalne skupine imaju neto pozitivan naboj.
Promjena pH na kiselu stranu (tj. Povećanje koncentracije H + u mediju) dovodi do supresije disocijacije kiselinskih skupina. U izrazito kiseloj sredini sve aminokiseline dobivaju pozitivan naboj.
Naprotiv, povećanje koncentracije OH - skupina uzrokuje eliminaciju H + iz glavnih funkcionalnih skupina, što dovodi do smanjenja pozitivnog naboja. U visoko alkalnom okruženju sve aminokiseline imaju neto negativan naboj.
5. Modificirane aminokiseline prisutne u proteinima
Samo 20 navedenih aminokiselina izravno sudjeluje u sintezi proteina u ljudskom tijelu. Međutim, neki proteini sadrže nestandardne modificirane aminokiseline - derivate jedne od ovih 20 aminokiselina.
Modifikacije aminokiselinskih ostataka već se provode u sastavu proteina, tj. tek nakon završetka njihove sinteze. Uvođenje dodatnih funkcionalnih skupina u strukturu aminokiselina daje proteinima svojstva potrebna za obavljanje određenih funkcija.
6. Kemijske reakcije koje se koriste za otkrivanje aminokiselina
Ninhidrinska reakcija može se koristiti za otkrivanje i kvantificiranje aminokiselina u otopini.
Ova se reakcija temelji na činjenici da se bezbojni ninhidrin, reagirajući s aminokiselinom, kondenzira u obliku dimera kroz atom dušika uklonjen iz amino skupine aminokiseline. Kao rezultat toga nastaje crveno-ljubičasti pigment. Istodobno dolazi do dekarboksilacije aminokiseline, što dovodi do stvaranja CO 2 i odgovarajućeg aldehida. Ninhidrinska reakcija se široko koristi u proučavanju primarne strukture proteina Budući da je intenzitet boje proporcionalan količini aminokiselina u otopini, koristi se za mjerenje koncentracije β-aminokiselina.
Specifične reakcije na pojedine aminokiseline
Kvalitativno i kvantitativno određivanje pojedinih aminokiselina moguće je zahvaljujući prisutnosti posebnih funkcionalnih skupina u njihovim radikalima.
Arginin se određuje kvalitativnom reakcijom na gvanidinsku skupinu (Sakaguchijeva reakcija), a cistein se detektira Follovom reakcijom, specifičnom za SH skupinu određene aminokiseline. Prisutnost aromatskih aminokiselina u otopini utvrđuje se ksantoproteinskom reakcijom (reakcija nitracije), a prisutnost hidroksilne skupine u aromatskom prstenu tirozina utvrđuje se Millonovom reakcijom.
B. Peptidna veza. Struktura i biološka svojstva peptida
3.Biološka uloga peptida
Ljudsko tijelo proizvodi mnoge peptide koji sudjeluju u regulaciji raznih bioloških procesa i imaju visoku fiziološku aktivnost.
Funkcije peptida ovise o njihovoj primarnoj strukturi. Angiotenzin I je po strukturi vrlo sličan angiotenzinu II (ima samo dvije dodatne aminokiseline na C-kraju), ali nema biološku aktivnost.
Promjene u aminokiselinskom sastavu peptida često dovode do gubitka jednih i pojave drugih bioloških svojstava.
Budući da su peptidi snažni regulatori bioloških procesa, mogu se koristiti kao lijekovi. Glavna prepreka terapijskoj upotrebi je njihovo brzo uništavanje u tijelu. Jedan od najvažnijih rezultata istraživanja nije samo proučavanje strukture peptida, već i proizvodnja sintetskih analoga prirodnih peptida s ciljanim promjenama njihove strukture i funkcija.
Trenutno otkriveni i proučavani peptidi mogu se podijeliti u skupine prema njihovom glavnom fiziološkom djelovanju:
peptidi s hormonskom aktivnošću (oksitocin, vazopresin, hormoni koji oslobađaju hipotalamus, hormon koji stimulira melanocite, glukagon itd.);
peptidi koji reguliraju probavne procese (gastrin, kolecistokinin, vazointestinalni peptid, želučani inhibitorni peptid itd.);
peptidi koji reguliraju vaskularni tonus i krvni tlak (bradikinin, kalidin, angiotenzin II);
peptidi koji reguliraju apetit (leptin, neuropeptid Y, hormon koji stimulira melanocite, (?-endorfini);
peptidi koji djeluju analgetski (enkefalini i endorfini te drugi opioidni peptidi). Analgetski učinak ovih peptida je stotinama puta veći od analgetskog učinka morfija;
peptidi uključeni u regulaciju više živčane aktivnosti, u biokemijskim procesima povezanim s mehanizmima spavanja, učenja, pamćenja, pojavom osjećaja straha itd.
3. Primarna struktura proteina. Peptidna veza, njezine karakteristike (jačina, višestrukost, koplanarnost, cis-, trans-izomerija). Važnost primarne strukture za normalno funkcioniranje proteina (na primjeru hemoglobina S).
Primarna struktura proteina je linearni polipeptidni lanac aminokiselina povezanih peptidnim vezama. Primarna struktura je najjednostavnija razina strukturne organizacije proteinske molekule. Visoku stabilnost daju mu kovalentne peptidne veze između α-amino skupine jedne aminokiseline i α-karboksilne skupine druge aminokiseline.
Ako je imino skupina prolina ili hidroksiprolina uključena u stvaranje peptidne veze, tada ona ima drugačiji izgled.
Kada se u stanicama stvaraju peptidne veze, najprije se aktivira karboksilna skupina jedne aminokiseline, a zatim se spaja s amino skupinom druge. Laboratorijska sinteza polipeptida provodi se približno na isti način.
Peptidna veza je ponavljajući fragment polipeptidnog lanca. Ima niz značajki koje utječu ne samo na oblik primarne strukture, već i na više razine organizacije polipeptidnog lanca:
koplanarnost - svi atomi uključeni u peptidnu skupinu nalaze se u istoj ravnini;
sposobnost postojanja u dva rezonantna oblika (keto ili enolni oblik);
trans položaj supstituenata u odnosu na C-N vezu;
sposobnost stvaranja vodikovih veza, a svaka od peptidnih skupina može tvoriti dvije vodikove veze s drugim skupinama, uključujući i peptidne.
Izuzetak su peptidne skupine koje uključuju amino skupinu prolina ili hidroksiprolina. Sposobni su formirati samo jednu vodikovu vezu. To utječe na stvaranje sekundarne strukture proteina. Polipeptidni lanac u području gdje se nalazi prolin ili hidroksiprolin lako se savija, jer ga ne drži, kao obično, druga vodikova veza.
Značajke primarne strukture proteina . U okosnici polipeptidnog lanca, krute strukture (ravne peptidne skupine) izmjenjuju se s relativno pokretljivim regijama (-CHR), koje su sposobne rotirati oko veza. Takve strukturne značajke polipeptidnog lanca utječu na njegov prostorni raspored.
2.Obilježja peptidne veze
Peptidna veza ima karakteristiku djelomične dvostruke veze, pa je kraća od ostalih veza peptidne okosnice i, kao rezultat toga, ima malu pokretljivost. Elektronska struktura peptidne veze određuje ravnu, krutu strukturu peptidne skupine. Ravnine peptidnih skupina nalaze se pod kutom jedna prema drugoj.
Veza između α-ugljikovog atoma i β-amino skupine ili β-karboksilne skupine sposobna je za slobodnu rotaciju (iako je ograničena veličinom i prirodom radikala), što omogućuje polipeptidnom lancu da poprimi različite konfiguracije.
Peptidne veze obično se nalaze u trans konfiguraciji, tj. Atomi α-ugljika nalaze se na suprotnim stranama peptidne veze. Kao rezultat toga, bočni radikali aminokiselina nalaze se na najvećoj udaljenosti jedan od drugog u prostoru.
Peptidne veze su vrlo jake i ne pucaju spontano u normalnim uvjetima koji postoje u stanicama (neutralno okruženje, tjelesna temperatura). U laboratorijskim uvjetima hidroliza proteinskih peptidnih veza provodi se u zatvorenoj ampuli s koncentriranom (6 mol/l) solnom kiselinom, na temperaturi višoj od 105 °C, te se odvija potpuna hidroliza proteina do slobodnih aminokiselina. za otprilike jedan dan.
U živim organizmima peptidne veze u proteinima se prekidaju uz pomoć posebnih proteolitičkih enzima (od engleskog, protein- protein, liza- destrukcija), također se nazivaju proteaze ili peptidne hidrolaze.
Za otkrivanje proteina i peptida u otopini, kao i za njihovo kvantitativno određivanje, koristi se biuretska reakcija (pozitivan rezultat za tvari koje sadrže najmanje dvije peptidne veze).
Kemijska priroda svakog proteina je jedinstvena i usko povezana s njegovom biološkom funkcijom. Sposobnost proteina da obavlja svoju inherentnu funkciju određena je njegovom primarnom strukturom. Čak i male promjene u slijedu aminokiselina u proteinu mogu dovesti do ozbiljnog poremećaja u njegovom funkcioniranju, uzrokujući ozbiljnu bolest. Bolesti povezane s poremećajima primarne strukture proteina nazivaju se molekularne bolesti. Do danas je otkriveno nekoliko tisuća takvih bolesti. Jedna od molekularnih bolesti je anemija srpastih stanica, čiji uzrok leži u kršenju primarne strukture hemoglobina. U osoba s kongenitalnom abnormalnošću u strukturi hemoglobina, polipeptidni lanac, koji se sastoji od 146 aminokiselinskih ostataka, ima valin na šestom mjestu, dok se u zdravih ljudi na ovom mjestu nalazi glutaminska kiselina. Abnormalni hemoglobin lošije prenosi kisik, a crvena krvna zrnca pacijenata imaju srpast oblik. Bolest se manifestira sporim razvojem i općom slabošću tijela.
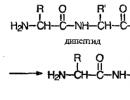
Ovi fragmenti su povezani peptidnom vezom:
Ova veza se zove dipeptid. U tom slučaju, dipeptid može reagirati s još jednom aminokiselinom, stvarajući tripeptid:

Formule peptidi napisano tako da je slobodna amino skupina s lijeve strane, a slobodna karboksilna skupina s desne strane.
Struktura peptida piše se skraćeno (ako peptid sadrži mnogo aminokiselinskih ostataka). Na primjer, vazopresin:
Ista se struktura može napisati u skraćenom obliku:
Kemijska svojstva peptida.
Glavno svojstvo peptida je njihova sposobnost hidrolize. Tijekom hidrolize dolazi do potpunog ili djelomičnog razaranja lanca, nakon čega nastaju peptidi kraće strukture. Do potpune hidrolize dolazi kada se peptid dugo zagrijava uz koncentriranu solnu kiselinu.
Hidroliza može biti kisela ili alkalna, a može se dogoditi i pod djelovanjem enzima. U kiselim i alkalnim sredinama nastaju soli aminokiselina, a enzimski proces teče selektivno, jer specifični fragmenti peptidnog lanca mogu se odcijepiti.
Biološki značaj peptida.
Mnogi peptidi pokazuju svoju biološku aktivnost. Najjednostavniji peptid je glutation, koji pripada klasi hormona. Građen je od ostataka glicina, cisteina i glutamina
Peptidi su poliamidi izgrađeni od a-aminokiselina. Na temelju broja aminokiselinskih ostataka u molekuli peptida razlikuju se dipeptidi, tripeptidi, tetrapeptidi itd. Peptidi koji sadrže do 10 aminokiselinskih ostataka nazivaju se oligopeptidi, više od 10 aminokiselinskih ostataka – polipeptidi. Prirodni polipeptidi koji sadrže više od 100 aminokiselinskih ostataka nazivaju se bjelančevine.
Struktura peptida
Formalno, peptide možemo smatrati produktima polikondenzacije aminokiselina.
Aminokiselinski ostaci u peptidu povezani su amidom ( peptid) veze. Jedan kraj lanca koji sadrži aminokiselinu sa slobodnom amino skupinom naziva se N-kraj. Drugi kraj, na kojem se nalazi aminokiselina sa slobodnom karboksilnom skupinom, naziva se C-kraj. Peptidi se obično pišu i imenuju počevši od N-kraja.
Naziv peptida temelji se na trivijalnim nazivima aminokiselinskih ostataka uključenih u njegov sastav, koji su navedeni počevši od N-kraja. U ovom slučaju, u imenima svih aminokiselina, s izuzetkom C-terminalnog sufiksa "in", zamjenjuje se sufiks "il". Za skraćeno označavanje peptida koriste se troslovne oznake aminokiselina koje ulaze u njegov sastav.

Peptid je karakteriziran aminokiselinski sastav I slijed aminokiselina.
Aminokiselinski sastav peptida može se odrediti potpunom hidrolizom peptida (cijepanjem na aminokiseline), nakon čega slijedi kvalitativna i kvantitativna analiza nastalih aminokiselina pomoću kromatografije ionske izmjene ili GLC analize estera aminokiselina. Potpuna hidroliza peptida provodi se u kiseloj sredini njihovim kuhanjem sa 6N. HCl.
Nekoliko peptida ima isti aminokiselinski sastav. Dakle, od 2 različite aminokiseline mogu se izgraditi 2 dipeptida, od tri različite aminokiseline - 6 tripeptida, od n različitih aminokiselina n! peptidi istog sastava. Na primjer, sljedećih 6 tripeptida odgovara sastavu Gly:Ala:Val=1:1:1.
Gly-Ala-Val Gly-Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu
Stoga je za potpunu karakterizaciju peptida potrebno znati njegov aminokiselinski sastav i aminokiselinski slijed.
Fizikalno-kemijska svojstva peptida određena su njihovim aminokiselinskim sastavom, odnosno peptidi mogu biti neutralni ili nabijeni, pokazivati kisela ili bazična svojstva, imati izoelektričnu točku i stoga se mogu razdvojiti elektroforetskim metodama ili kromatografski.
U prirodi postoje dvije vrste peptida, od kojih se jedna sintetizira i ima fiziološku ulogu u životu organizma, a druga nastaje kemijskom ili enzimskom hidrolizom proteina u tijelu ili izvan njega. Peptidi nastali tijekom hidrolize izvan tijela (in vitro) naširoko se koriste za analizu sekvence aminokiselina proteina.
Enzimsko stvaranje peptida događa se u ljudskom gastrointestinalnom traktu tijekom probave proteina hrane. Počinje u želucu pod utjecajem pepsina, gastriksina i završava u želucu pod djelovanjem pepsina, gastriksina i završava u crijevu uz sudjelovanje tripsina, kimotripsina, amino- i karboksipeptidaza. Razgradnju kratkih peptida dovršavaju di- i tripeptidi uz stvaranje slobodnih aminokiselina, koje služe za sintezu proteina i drugih aktivnih spojeva.
Za mnoge prirodne peptide utvrđena je struktura i uloga. Na slici je prikazan fiziološki značaj i funkcionalna uloga najčešćih skupina peptida o kojima ovisi ljudsko zdravlje te organoleptička i sanitarna svojstva prehrambenih proizvoda.
PEPTIDI prirodna ili sintetička. spojevi, koji su građeni od a-aminokiselinskih ostataka međusobno povezanih peptidnim (amidnim) vezama C(O)NH. Može također sadržavati komponentu koja nije aminokiselina (na primjer, ostatak). Na temelju broja aminokiselinskih ostataka uključenih u peptide razlikuju se di-peptidi, tripeptidi, tetrapeptidi itd. Peptidi koji sadrže do 10 aminokiselinskih ostataka nazivaju se. oligopeptidi koji sadrže više od 10 aminokiselinskih ostataka Prir polipeptidi s mol. m. više od 6 tisuća imena.
Povijesni podaci. Prvi put su peptidi izolirani iz enzimskih hidrolizata. Pojam "peptidi" predložio je E. Fischer. Prvi sintetski peptid dobio je T. Curtius 1881. E. Fischer je do 1905. razvio prvu opću metodu za sintezu peptida i sintetizirao niz oligopeptida. građevine. Stvorenja Učenici E. Fischera E. Abdergalden, G. Leike i M. Bergman pridonijeli su razvoju peptida. Godine 1932. M. Bergman i L. Zerwas upotrijebili su benziloksikarbonilnu skupinu (karbobenzoksi skupinu) u sintezi peptida za zaštitu a-amino skupina, što je označilo novu fazu u razvoju sinteze peptida. Dobivene N-zaštićene (N-karbobenzoksiaminokiseline) naširoko su korištene za dobivanje raznih peptida, koji su uspješno korišteni za proučavanje niza ključnih problema i ovih B-B, na primjer, za proučavanje proteolitičkih supstrata. . Koristeći N-karbobenzoksiaminokiseline, prvi su sintetizirani (, itd.).
Važno postignuće na ovom području razvilo se u početku. 50-ih godina P. Vaughan et al. sinteza peptida mješovitom metodom (metode za sintezu peptida detaljno su razmotrene u nastavku). Godine 1953. V. Du Vigneault sintetizira prvi peptid -oksitocin.
Na temelju koncepta čvrste faze sinteze peptida koju je razvio P. Merrifield 1963. stvorene su automatske. sintetizatori peptida. Intenzivno se razvijaju metode za kontroliranu enzimatsku sintezu peptida. Korištenje novih metoda omogućilo je provođenje sinteze itd. Uspjesi sintetikedolazi od imena. aminokiselinske ostatke uključene u njegov sastav, navedene redom, počevši od N-terminalnog. U ovom slučaju koriste se trivijalni nazivi. , u kojem je završetak “in” zamijenjen s “il”; isključenje C-terminalnog ostatka, tzv koji se poklapa s imenom. odgovarajući .
Svi aminokiselinski ostaci uključeni u peptide numerirani su počevši od N-kraja. Za bilježenje primarne strukture peptida (), naširoko se koriste troslovne i jednoslovne oznake za aminokiselinske ostatke (na primjer, Ala Ser -Asp Phe -GIy alanil-seril-asparagil-fenilalanil-glicin). Struktura.
ima svetaca djelomično. To se očituje u smanjenju duljine ove veze (0,132 nm) u usporedbi s duljinom C N (0,147 nm). Djelomično dvostruko povezana priroda čini slobodu nemogućom. rotacija supstituenata oko njega. stoga je peptidna skupina planarna i obično ima trans konfiguraciju (f-la I). Dakle, okosnicu peptidnog lanca čini niz krutih ravnina s pomičnim ("šarkarskim") spojem na mjestu gdje se nalaze asimetrični dijelovi.
C (u obrascu I označeni su zvjezdicom).
U otopinama peptida uočeno je preferirano stvaranje određenih konformera. Kako se lanac produljuje, uređeni elementi sekundarne strukture (a-heliks i b-struktura) dobivaju izraženiju stabilnost (slično). Formiranje sekundarne strukture posebno je karakteristično za regularne peptide, posebice poliaminokiseline.
Svojstva. Oligopeptidi su bliski i slični po svojstvima. Oligopeptidi su obično kristalni. tvari koje se zagrijavanjem raspadaju. do 200 300 0 C. Dobro su topljivi. u , dil. to-tah i, gotovo da nema rješenja. u org. r-trgovci na malo.
peptidi klorovodične kiseline se hidroliziraju unutar 24 sata na 105 0 C.
Sinteza. Chem. Sinteza peptida sastoji se od stvaranja između COOH skupine jednog i NH 2 drugog ili peptida. U skladu s tim razlikuju se karboksilne i aminske komponente procesa sinteze peptida. Za provedbu ciljane, kontrolirane sinteze peptida potrebno je prethodno. privremena zaštita svih (ili nekih) funkcija. grupe koje ne sudjeluju u edukaciji, kao i prelimin. aktivacija jedne od komponenti sinteze peptida. Nakon što je sinteza završena, uklanja se. Pri dobivanju biološki aktivnih peptida nužan uvjet je prevencija u svim fazama sinteze peptida.
Naib. važne metode obrazovanja pri provođenju r-cije u r-re-metode aktiviranje. eteri, karbodiimid, miješane i azidne metode.
Metoda aktiviranih estera temelji se na pre- nastajanje esterskog derivata karboksilne komponente uvođenjem u njega alkoholnog ostatka koji sadrži jaki supstituent koji privlači elektrone. Kao rezultat, nastaje visoko reaktivan ester, koji se lako podvrgava djelovanju amino komponente sinteze peptida. Kao aktivator esteri u sintezi peptida, penta-fluoro-, pentaklor-, trikloro- i n-nitrofenil i niz drugih zaštićenih estera i peptida naširoko se koriste.
Metoda stvaranja karbodiimida uključuje korištenje kondenzacijske razgradnje. zamijenio Dicikloheksil-karbodiimid se posebno široko koristi u sintezi peptida:

X i Y-odn. N- i C-zaštitne skupine Ovim kondenzatorom moguće je izvesti sintezu peptida u vodenom mediju, budući da se brzine reakcija i intermedijarnog stvaranja O-acilizoureje (II) značajno razlikuju. U sintezi peptida također se koriste različiti spojevi. u vodi topivi karbodiimidi (na primjer, N-dimetilaminopropil-N"-etilkarbodiimid).
Mješovita metoda temelji se na preliminarnoj aktivacija karboksilne komponente sinteze peptida stvaranjem smjese pomiješane s karboksilnim ili anorganskim. WHO. Naib.

često se koriste alkilni esteri spojeva kloromravlje kiseline (karbonski klorid), osobito etil i izobutil eteri, na primjer:
Kod sintetiziranja peptida ovom metodom vrlo su učinkovite miješane N-acilaminokiseline i pivalne (trimetiloctene) kiseline. Zahvaljujući snažnom stavu. tert-butilnu skupinu, elektrofilnost karboksilne C u ostatku pivalinske kiseline značajno je smanjena, a to, zajedno sa steričkom. prepreke, potiskuje nepoželjne
kolateralno obrazovanje i besplatno. N-acilaminokiseline, rubovi se izvode prema shemi:
U jednoj od varijanti mješovite metode kao sredstvo za kondenzaciju koristi se 1-etoksikarbonil-2-etoksi-1,2-dihidrokinolin.
Ovo je veza. lako tvori intermedijer s karboksilnom komponentom sinteze peptida.

mješoviti, brzo ulazeći u okrug, a nepoželjni predmeti potpuno su isključeni. bočna distribucija.Poseban slučaj mješovite metode je simetrična metoda. , u kojem se koristi 2 O. Njihova uporaba eliminira mogućnost nepravilne uporabe.
Metoda sinteze azida uključuje aktivaciju karboksilne komponente njezinom pretvorbom u N-supstituirani ili peptid:
Zbog njihove nestabilnosti u slobodnom. oblik iz otopine, u pravilu, nije izoliran. Ako se umjesto alkil estera dušikovih spojeva (na primjer, tert-butilnitrit) za otopinu s hidrazidom, azid može provesti u org. r-ritele; nastali HN 3 vežu tercijari. Često se problem azida komplicira neželjenim problemima. nuspojave (pretvaranje hidrazida ne u , nego u amid; otopina

Naib. važne metode isključenja: 1) produženje peptidnog lanca u smjeru od C-kraja prema N-krajukoristeći N-zaštitne skupine kao što je ROC(O). 2) Aktivacija N-zaštićenih peptidnih fragmenata s C-terminalnim ostacima ili . 3) Korištenje azidne metode (u nedostatku viška tercijara i održavanju niskih temperatura u reakcijskom mediju). 4) Aplikacija aktiv. eteri, koji prolaze kroz prijelazno stanje, stabilizator. vodikovi mostovi (na primjer, esteri formirani s N-hidroksipiperidinom i 8-hidroksikinolinom). 5) Korištenje karbodiimidne metode s N-hidroksi spojem. ili Lewisov ured.
Uz sintezu peptida u otopinama važna je i sinteza peptida pomoću netopljivih peptida.
Uključuje peptide (metoda ili metoda Maryfield) i sintezu peptida pomoću polimera.


Strategija sinteze peptida u čvrstoj fazi uključuje privremenu fiksaciju sintetiziranog peptidnog lanca na netopljivom polimeru i provodi se prema sljedećoj shemi:
Zahvaljujući ovoj metodi bilo je moguće zamijeniti vrlo složene i radno intenzivne postupke odvajanja i pročišćavanja intermedijera. peptide jednostavnim ispiranjem i operacijama ispiranja, kao i svođenjem procesa sinteze peptida na standardni slijed postupaka koji se periodički ponavljaju i koji se lako mogu automatizirati. Merrifieldova metoda omogućila je značajno ubrzanje procesa sinteze peptida. Na temelju ove metodologije, različite vrste tipovi automatski
sintetizatori peptida.
Veza je vrlo produktivna.