Удивительные свойства пептидов. Все о пептидах и антивозрастная косметика с пептидами Пептиды способы их получения пептидная связь
ПЕПТИДЫ - биополимеры, молекула к-рых построена из аминокислотных остатков, соединенных пептидной связью (-CO-NH-); в биохимии пептидами принято называть низкомолекулярные фрагменты белковых молекул, состоящих из небольшого числа аминокислотных остатков (от двух до нескольких десятков). Многие П. обладают биол, активностью. Гидролитическое расщепление П. катализируется специфическими ферментами - пептид-гидролазами (см.). Наиболее интересную и важную группу биологически активных П. составляют пептидные гормоны. К ним относятся: гормоны гипоталамуса: тиролиберин, гонадолиберин, соматостатин (см. Гипоталамические нейрогормоны); гормоны гипофиза: вазопрессин (см.), окситоцин (см.), адренокортикотропный гормон (см.), липотропин (см. Липотропные факторы гипофиза); гормон щитовидной железы - кальцитонин (см.); гормон поджелудочной железы - глюкагон , (см.); гормоны жел.-киш. тракта: секретин (см.), гастрин (см.), панкреозимин, а также ангиотензин (см.), брадикинин и каллидин (см. Медиаторы аллергических реакций). К природным П. относятся нек-рые антибиотики (грамицидин С и др.), ионофоры (антаманид и др.), ингибиторы протеиназ, яды змей и насекомых, а также биологически активные ди- и трипептиды: глутатион (см.), карнозин (см.) и ансерин (см.), принимающие участие во многих биохим, процессах, протекающих в клетке. Особую группу П. составляют эндогенные опиаты (см. Опиаты эндогенные), а также гормоны сна, стимуляторы памяти и другие так наз. нейропептиды.
Почти все биологически активные П., в т. ч. пептидные гормоны, кинины (см.), энкефалины и др., синтезируются в организме в виде белковых предшественников, из к-рых они образуются в результате специфического гидролиза определенных пептидных связей под действием пептид-гидролаз. П. выполняют важную функцию в организме. Гипоталамические нейрогормоны регулируют деятельность гипофиза, контролирующего функцию многих периферических эндокринных желез. П., обладающие морфиноподобным действием, влияют на механизмы восприятия болевых стимулов и другие процессы, протекающие в мозге. Вазопрессин, окситоцин, кортикотропин и меланотропин, помимо хорошо известных эффектов, оказывают влияние на поведение, память, мотивацию и обучение. Пептидные гормоны жел.-киш. тракта и Гипоталамические нейрогормоны, кроме тех органов, из к-рых они были выделены впервые, обнаружены в заметных количествах в различных структурах головного мозга.
Хим. и биол, свойства П. зависят от свойств пептидной связи и последовательности аминокислотных остатков в молекуле пептида. В каждом П., за исключением циклических, имеются аминный и карбоксильный концы молекулы (NH 2 - и COOH-концы соответственно). В общем виде структура П. может быть представлена в следующем виде:
Где R1, R2, R3, ..., Rn - боковые радикалы аминокислотных остатков. Пептидная связь имеет жесткую структуру, все ее атомы находятся в транс-положении и располагаются в одной плоскости. Наибольшими степенями свободы обладают связи, располагающиеся с двух сторон от альфа-углеродного атома, а именно связи - C α -NH- и C α -CO-, вокруг которых может вращаться вся пептидная цепь, что позволяет П. в р-ре принимать различную пространственную структуру - конформацию (см.).
В зависимости от количества аминокислотных остатков, входящих в состав молекулы, пептиды называются ди-, три-, тетрапептидами и т. д., олигопептидами и полипептидами. Наименование П. начинается с названия аминокислоты, имеющей свободную a-NH2- группу, к к-рому прибавляется суффикс -ил. Суффикс -ил включается и в название всех остальных аминокислотных остатков, за исключением аминокислоты, имеющей свободную COOH-группу, название к-рой не изменяется. Например, трипептид NH 2 -Глу-Гис-Фен-COOH получил название глутамил-гистидил-фенилаланин.
П. являются амфотерными электролитами (см. Амфолиты) и обычно хорошо растворимы в воде. Поскольку П. способны нести электрический заряд, для препаративного разделения их смеси и очистки индивидуальных П. широко используют различные методы ионообменной хроматографии (см.) и электрофореза (см.), особенно высоковольтный электрофорез. Благодаря наличию асимметрических a-угле родных атомов П. обладают оптической активностью. Электронные переходы пептидной связи обусловливают существование полосы поглощения П. в ультрафиолетовой части спектра при 180-230 нм, а присутствие в П. остатков ароматических аминокислот- триптофана, тирозина и фенилаланина - объясняет наличие максимума поглощения в области 280 нм. На этих свойствах основаны нек-рые количественные методы определения П. Валентные колебания NH- и CO-групп обусловливают интенсивные полосы поглощения в инфракрасной части спектра при 3300 см -1 , 3080 см -1 и 1660 см -1 .
П. дают характерную цветную реакцию с нингидрином (см.), к-рый используется для проявления П. на бумаге после распределительной хроматографии или электрофореза. Существуют специфические реактивы, взаимодействующие с N-концевой аминогруппой П., такие, как фенилизотиоцианат, дансилхлорид, динитрофторбензол и др., позволяющие идентифицировать N-концевой аминокислотный остаток в П. Фенилизотиоцианат, кроме того, дает возможность последовательно отщеплять аминокислотные остатки от NH 2 -конца П. и т. о. устанавливать его первичную структуру (метод Эдмана). Знание структуры П. позволяет получать их синтетическим путем и широко использовать синтетические физиологически активные П. в мед. практике и при экспериментальных исследованиях.
Наиболее простой качественной реакцией на пептидную связь является биуретовая реакция (см.). Значительную трудность представляет собой количественное определение биологически активных П., т. к. они присутствуют в биол, жидкостях и тканях в ничтожных количествах. Поэтому для количественного определения индивидуальных биологически активных П. широко пользуются радиоиммунологическими методами (см.), обладающими высокой специфичностью и чувствительностью. С помощью радиоиммунологических методов получены практически все сведения об изменениях концентрации биологически активных П. в крови и тканях человека в норме и при различных патологических состояниях.
Библиография: Ашмарин И. П. и др. Олигопептиды мозга - анальгетики, стимуляторы памяти и сна, Молек. биол., т. 12, № 5, с. 965, 1978, библиогр.; Биохимия гормонов и гормональной регуляции, под ред. Н. А. Юдаева, с. 44, М., 1976; Дзвени Т. и Гергей Я. Аминокислоты, пептиды и белки, пер. с англ., М., 1976; Ленинджер А. Биохимия, пер. с англ., М., 1976; Шредер Э. и Любке К. Пептиды, пер. с англ., т. 1-2, М., 1967-1969.
1.Предмет и задачи биологической химии. Биохимия как молекулярный уровень изучения структурной организации, анаболизма и катаболизма живой материи. Место биохимии среди других биологических дисциплин. Значение биохимии в подготовке врача и для медицины.
Биохимия – это наука о химическом составе живой материи, химических процессах, происходящих в живых организмах, а также связи этих превращений с деятельностью органов и тканей. Таким образом, биохимия состоит как бы из трех частей: 1) статическая биохимия (это анализ химического состава живых организмов); 2) динамическая биохимия (изучает совокупность превращения веществ и энергии в организме); 3) функциональная биохимия (исследует процессы, лежащие в основе различных проявлений жизнедеятельности).
Главным для биохимии является выяснение функционального, то есть биологического назначения всех химических веществ и физико-химических процессов в живом организме, а также механизм нарушения этих функций при разных заболеваниях. Современная биохимия решает следующие задачи : 1. Биотехнологическую, т.е. создание фармацевтических препаратов (гормонов, ферментов), регуляторов роста растений, средств борьбы с вредителями, пищевых добавок. 2. Проводит разработку новых методов и средств диагностики и лечения наследственных заболеваний, канцерогенеза, природы онкогенов и онкобелков. 3. Проводит разработку методов генной и клеточной инженерии для получения принципиально новых пород животных и форм растений с более ценными признаками. 4. Изучает молекулярные основы памяти, психики, биоэнергетики, питания и целый ряд других задач.
Биологическая химия изучает молекулярные процессы, лежащие в основе развития и функционирования организмов. Биохимия использует методы «молекулярных» наук - химии, физической химии, молекулярной физики, и в этом отношении биохимия сама является молекулярной наукой. Однако главные конечные задачи биохимии лежат в области биологии: она изучает закономерности биологической, а не химической формы движения материи. С другой стороны, «молекулярные изобретения» природы, открываемые биохимиками, находят применение в небиологических отраслях знания и в промышленности (молекулярная бионика, биотехнология). В таких случаях биохимия выступает в роли метода, а предметом исследований и разработок являются проблемы, выходящие за пределы биологии.
Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. Обмен веществ включает 3 этапа: поступление веществ в организм, метаболизм и выделение конечных продуктов из организма.
Поступление веществ в организм происходит в результате дыхания (кислород) и питания. В ЖКТ продукты питания перевариваются (расщепляются до простых веществ). При переваривании происходит гидролиз полимеров (белков, полисахаридов и других сложных органических веществ) до мономеров, всасывающихся в кровь и включающихся в промежуточный обмен.
Промежуточный обмен (внутриклеточный метаболизм) включает 2 типа реакций: катаболизм и анаболизм.
Катаболизм - процесс расщепления органических молекул до конечных продуктов. Конечные продукты превращений органических веществ у животных и человека - СО 2 , Н 2 О и мочевина. В процессы катаболизма включаются метаболиты, образующиеся как при пищеварении, так и при распаде структурно-функциональных компонентов клеток.
Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции).
Анаболизм объединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме (эндергонические реакции).
Практически любое заболевание начинается с повреждения (нарушения) одной реакции в метаболизме клетки, а затем оно распространяется на ткань, орган и целый организм. Нарушение метаболизма ведет к нарушению гомеостаза в биологических жидкостях организма человека, что сопровождается изменением биохимических показателей.
Большое значение клинико-биохимических методов исследования биологических жидкостей велико в медицине и важно для подготовки медицинских лабораторных техников. Достаточно напомнить, что только в крови человека можно определить современными методами биохимических исследований около 1000 показателей метаболизма.
Биохимические показатели биологических сред организма человека широко используются при:
1. постановке диагноза заболевания, особенно дифференциального диагноза;
2. выборе метода лечения;
3.контроле за правильностью назначенного лечения;
4.результаты биохимических анализов служат одним из критериев излеченности патологического процесса;
5.скрининге (выявлении болезни на доклинической стадии);
6.мониторинге (контроле за течением заболевания и результатом лечения);
7. прогнозе (информации о возможном исходе заболевания).
2. Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды.
Биологическая роль аминокислот и пептидов.
1. Общие структурные особенности аминокислот, входящих в состав белков
Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же?-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение. В водных растворах при нейтральном значении рН?- аминокислоты существуют в виде биполярных ионов. В отличие от 19 остальных?-аминокислот, пролин - иминокислота, радикал которой связан как с?-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
19 из 20 аминокислот содержат в?-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного?-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и неферментативно превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-аминокислоты при данной температуре идёт с определённой скоростью. Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к?-углеродному атому.
2. Классификация аминокислот по химическому строению радикалов
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические
В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН), амино (-NH 2), тиольная (-SH), амидная (-CO-NH 2), гидроксильная (-ОН) и гуанидиновая группы.
Для записи аминокислотных остатков в молекулах пептидов и белков используют трёхбуквенные сокращения их тривиальных названий, а в некоторых случаях и однобуквенные символы
3. Классификация аминокислот по растворимости их радикалов в воде
Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными.
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают).
Аминокислоты с неполярными радикалами
К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.
Аминокислоты с полярными незаряженными радикалами
Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серии, треонин и тирозин, имеющие гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цистеин с его тиольной группой.
Аминокислоты с полярными отрицательно заряженными радикалами
К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при рН около 7,0 диссоциирующую с образованием СОО - и Н + . Следовательно, радикалы данных аминокислот - анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
Аминокислоты с полярными положительно заряженными радикалами
Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. У лизина вторая аминогруппа, способная присоединять Н + , располагается в?-положении алифатической цепи, а у аргинина положительный заряд приобретает, гуанидиновая группа, Кроме того, гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений рН (от 6,9 до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп - отдавать протон, теряя положительный заряд радикала. Положительно заряженные радикалы - катионы.Наибольшей растворимостью в воде обладают полярные заряженные радикалы аминокислот.
4. Изменение суммарного заряда аминокислот в зависимости от рН среды
При нейтральных значениях рН все кислотные (способные отдавать Н +) и все основные (способные присоединять Н +) функциональные группы находятся в диссоциированном состоянии.
Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, - положительный заряд
Изменение рН в кислую сторону (т.е. повышение в среде концентрации Н +) приводит к подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд.
Напротив, увеличение концентрации ОН - групп вызывает отщепление Н + от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд.
5. Модифицированные аминокислоты, присутствующие в белках
Непосредственно в синтезе белков организма человека принимают участие только 20 перечисленных аминокислот. Однако в некоторых белках имеются нестандартные модифицированные аминокислоты - производные одной из этих 20 аминокислот.
Модификации аминокислотных остатков осуществляются уже в составе белков, т.е. только после окончания их синтеза. Введение дополнительных функциональных групп в структуру аминокислот придаёт белкам свойства, необходимые для выполнения ими специфических функций.
6. Химические реакции, используемые для обнаружения аминокислот
Для обнаружения и количественного определения аминокислот, находящихся в растворе, можно использовать нингидриновую реакцию.
Эта реакция основана на том, что бесцветный нингидрин, реагируя с аминокислотой, конденсируется в виде димера через атом азота, отщепляемый от?-аминогруппы аминокислоты. В результате образуется пигмент красно-фиолетового цвета. Одновременно происходит декарбоксилирование аминокислоты, что приводит к образованию СО 2 и соответствующего альдегида. Нингидриновую реакцию широко используют при изучении первичной структуры белков Так как интенсивность окраски пропорциональна количеству аминокислот в растворе, её используют для измерения концентрации?-аминокислот.
Специфические реакции на отдельные аминокислоты
Качественное и количественное определение отдельных аминокислот возможно благодаря наличию в их радикалах особенных функциональных групп.
Аргинин определяют с помощью качественной реакции на гуанидиновую группу (реакция Сакагучи), а цистеин выявляют реакцией Фоля, специфичной на SH-группу данной аминокислоты. Наличие ароматических аминокислот в растворе определяют ксантопротеиновой реакцией (реакция нитрования), а наличие гидроксильной группы в ароматическом кольце тирозина - с помощью реакции Миллона.
Б. Пептидная связь. Строение и биологические свойства пептидов
3.Биологическая роль пептидов
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью.
Функции пептидов зависят от их первичной структуры. Ангиотензин I по структуре очень похож на ангиотензин II (имеет только две дополнительные аминокислоты с С-конца), но при этом не обладает биологической активностью.
Изменение в аминокислотном составе пептидов часто приводит к потере одних и возникновению других биологических свойств.
Так как пептиды - мощные регуляторы биологических процессов, их можно использовать как лекарственные препараты. Основное препятствие для терапевтического использования - их быстрое разрушение в организме. Одним из важнейших результатов исследований является не только изучение структуры пептидов, но и получение синтетических аналогов природных пептидов с целенаправленными изменениями в их структуре и функциях.
Открытые и изученные в настоящее время пептиды можно разделить на группы по их основному физиологическому действию:
пептиды, обладающие гормональной активностью (окситоцин, вазопрессин, рилизинг-гормоны гипоталамуса, меланоцитстимулирующий гормон, глюкагон и др.);
пептиды, регулирующие процессы пищеварения (гастрин, холецистокинин, вазоинтестиналшый пептид, желудочный ингибирующий пептид и др.);
пептиды, регулирующие тонус сосудов и АД (брадикинин, калидин, ангиотензин II);
пептиды, регулирующие аппетит (лептин, нейропептид Y, меланоцитстимулирующий гормон, (?-эндорфины);
пептиды, обладающие обезболивающим действием (энкефалины и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
пептиды, участвующие в регуляции высшей нервной деятельности, в биохимических процессах, связанных с механизмами сна, обучения, памяти, возникновения чувства страха и т.д.
3. Первичная структура белков. Пептидная связь, ее характеристика (прочность, кратность, компланарность, цис- ,транс- изомерия). Значение первичной структуры для нормального функционирования белков (на примере гемоглобина S ).
Первичной структурой белков называется линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. Первичная структура - простейший уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты
Если в образовании пептидной связи участвует иминогруппа пролина или гидроксипролина, то она имеет другой вид.
При образовании пептидных связей в клетках сначала активируется карбоксильная группа одной аминокислоты, а затем она соединяется с аминогруппой другой. Примерно так же проводят лабораторный синтез полипептидов.
Пептидная связь является повторяющимся фрагментом полипептидной цепи. Она имеет ряд особенностей, которые влияют не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи:
копланарность - все атомы, входящие в пептидную группу, находятся в одной плоскости;
способность существовать в двух резонансных формах (кето- или енольной форме);
транс-положение заместителей по отношению к С-N-связи;
способность к образованию водородных связей, причем каждая из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными.
Исключение составляют пептидные группы с участием аминогруппы пролина или гидроксипролина. Они способны образовывать только одну водородную связь. Это сказывается на формировании вторичной структуры белка. Полипептидная цепь на участке, где находится пролин или гидроксипролин, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
Особенности первичной структуры белка . В остове полипептидной цепи чередуются жесткие структуры (плоские пептидные группы) с относительно подвижными участками (-СНR), которые способны вращаться вокруг связей. Такие особенности строения полипептидной цепи влияют на укладку ее в пространстве.
2.Характеристика пептидной связи
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу.
Связь между?-углеродным атомом и?-аминогруппой или?-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. ?-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве.
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки.
В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ, protein - белок, lysis - разрушение), называемых также протеазами, или пептидгидролазами.
Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей).
Химическая природа каждого белка уникальна и тесно связана с его биологической функцией. Способность белка выполнять присущую ему функцию определяется его первичной структурой. Даже небольшие изменения в последовательности аминокислот в белке могут привести к серьезному нарушению в его функционировании, возникновению тяжелого заболевания. Болезни, связанные с нарушениями первичной структуры белка, получили название молекулярных. К настоящему времени открыто несколько тысяч таких болезней. Одной из молекулярных болезней является серповидноклеточная анемия, причина которой кроется в нарушении первичной структуры гемоглобина. У людей с врожденной аномалией структуры гемоглобина в полипептидной цепочке, состоящей из 146 аминокислотных остатков, в шестом положении находится валин, тогда как у здоровых людей на этом месте - глутаминовая кислота. Аномальный гемоглобин хуже транспортирует кислород, а эритроциты крови больных имеют серповидную форму. Заболевание проявляется в замедлении развития, общей слабости организма.
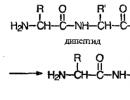
Эти фрагменты связаны пептидной связью:
Это соединение называется дипептидом . При этом дипептид может реагировать еще с одной аминокислотой, образую трипептид :

Формулы пептидов з аписывают так, чтобы свободная аминогруппа находилась слева, а свободная карбоксильная группа - справа.
Структуру пептидов записывают в сокращенном виде (если в пептиде много остатков аминокислот). Например, вазопрессин:
Эту же структуру можно написать в сокращенном виде:
Химические свойства пептидов.
Основным свойством пептидов является их способность к гидролизу . При гидролизе происходит полное или частичное разрушение цепи, после чего образуются пептиды более короткого строения. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Гидролиз может быть кислотным и щелочным, а также может протекать под действием ферментов. В кислой и щелочной среде образуются соли аминокислот, а ферментативный процесс протекает селективно, т.к. можно расщепить конкретные фрагменты цепи пептида.
Биологическое значение пептидов.
Многие пептиды проявляют свою биологическую активность. Простейший пептид - глутатион, который относится к классу гормонов. Он построен из остатков глицина, цистеина и глутаминовой
Петиды – это полиамиды, построенные из a -аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами , более 10 аминокислотных остатков – полипептидами . Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками .
Строение пептидов
Формально пептиды можно рассматривать как продукты поликонденсации аминокислот.
Аминокислотные остатки в пептиде связаны амидными (пептидными ) связями. Один конец цепи, на котором находится аминокислота со свободной аминогруппой, называют N-концом . Другой конец, на котором находится аминокислота со свободной карбоксильной группой, называют С-концом . Пептиды принято записывать и называть, начиная с N-конца.
Название пептида строят на основе тривиальных названий, входящих в его состав аминокислотных остатков, которые перечисляют, начиная с N-конца. При этом в названиях всех аминокислот за исключением С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения пептидов используют трехбуквенные обозначения входящих в его состав аминокислот.

Пептид характеризуется аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептида может быть установлен путем полного гидролиза пептида (расщепления до аминокислот) с последующим качественным и количественным анализом образовавшихся аминокислот методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот. Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н. HCl.
Одному и тому же аминокислотному составу отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено 2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu
Таким образом, для полной характеристики пептида необходимо знать его аминокислотный состав и аминокислотную последовательность.
Физико-химические свойства пептидов определяются аминокислотным составом, то есть пептиды могут быть нейтральными или заряженными, проявлять кислотные или основные свойства, они имеют изоэлектрическую точку и поэтому могут быть разделены электрофоретическими методами или же храматографически.
В природе существует два вида пептидов, один из которых синтезируется и выполняет физиологическую роль в процессе жизнидеятельности организма, другой образуется за счет химического или ферментативного гидролиза белков в организме или вне его. Пептиды, образующиеся в процессе гидролиза вне организма (in vitro), широко используются для анализа аминокислотной последовательности белков.
Ферментативное образование пептидов происходит в желудочно-кишечном тракте человека в процессе переваривания белков пищи. Оно начинается в желудке под действием пепсина, гастриксина и заканчивается в желудке под действием пепсина, гастриксина и заканчивается в кишечнике при участии трипсина, химотрипсина, амино- и карбоксипептидаз. Распад коротких пептидов завершается ди- и трипептидами с образованием свободных аминокислот, которые расходуются на синтез белков и других активных соединений.
Для многих природных пептидов установлена структура и роль. На рисунке отображены физиологическое значение и функциональная роль наиболее распространенных групп пептидов, от которых зависят здоровье человека и органолептические и санитарно-гигиенические свойства пищевых продуктов.
ПЕПТИДЫ
, природные
или синтетич. соед., к-рых построены из остатков a
-аминокислот,
соединенных между собой пептидными (амидными) связями C(O) NH. Могут содержать
в также неаминокислотную компоненту (напр., остаток ). По числу
аминокислотных остатков, входящих в пептидов, различают ди-пептиды, трипептиды,
тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, наз. олигопептидами,
содержащие более 10 аминокислотных остатков полипепти-дами Прир
с мол. м. более 6 тыс. наз.
Историческая справка.
Впервые пептиды были выделены из ферментативных гидролизатов . Термин "пептиды"
предложен Э. Фишером. Первый синтетический пептид получил T. Курциус в 1881 Э.
Фишер к 1905 разработал первый общий метод синтеза пептидов и синтезировал ряд олигопептидов
разл. строения. Существ. вклад в развитие пептидов внесли ученики Э. Фишера
Э. Абдергальден, Г. Лейке и M. Бергман. В 1932 M Бергман и Л. Зервас использовали
в синтезе пептидов бензилоксикарбонильную группу (карбобензоксигруппу) для защиты
a
-аминогрупп , что ознаменовало новый этап в развитии синтеза
пептидов. Полученные N-защищенные (N-карбобензоксиаминокислоты) широко
использовали для получения различных пептидов, к-рые успешно применяли для изучения
ряда ключевых проблем и этих B-B, напр, для исследования субстратной
протеолитич. . С применением N-карбобензоксиаминокислот
были впервые синтезированы ( , и др.).
Важное достижение в этой области разработанный в нач. 50-х гг. P. Воганом и
др. синтез пептидов методом смешанных (подробно методы синтеза пептидов рассмотрены
ниже). В 1953 В. Дю Виньо синтезировал первый пептидный -окситоцин.
На основе разработанной P. Меррифилдом в 1963 концепции твердофазного пептидного
синтеза были созданы автоматич. синтезаторы пептидов. Получили интенсивное развитие
методы контролируемого ферментативного синтеза пептидов. Использование новых методов
позволило осуществить синтез и др.
Успехи синтетич.
пептидов были подготовлены достижениями в области разработки таких ,
очистки и анализа пептидов, как , на разл.
, гель-фильтрация, высокоэффективная (ВЭЖХ),
иммуно-хим. анализ и др. Получили большое развитие также методы анализа концевых
групп и методы ступенчатого расщепления пептидов. Были, в частности, созданы автоматич.
аминокислотные анализаторы и автоматич. приборы для определения первичной структуры
пептидов-т.наз. секвенаторы.
Номенклатура пептидов.
Аминокислотный
остаток пептидов, несущий своб. a
-аминогруппу, наз. N-концевым, а несущий своб.
a
-карбоксильную группу - С-концевым. Название пептида образу
ется
из назв. входящих в его состав аминокислотных остатков, перечисляемых последовательно,
начиная с N-концево-го. При этом используют тривиальные назв. , в
к-рых окончание "ин" заменяется на "ил"; исключение
C-концевой остаток, назв. к-рого совпадает с назв. соответствующей .
Все аминокислотные остатки, входящие в пептиды, нумеруются, начиная с N-конца. Для
записи первичной структуры пептидов () широко используют
трехбуквенные и однобуквенные обозначения аминокислотных остатков (напр., Ala
Ser -Asp Phe -GIy аланил-серил-аспарагил-фенилаланил-гли-цин).
Строение.
имеет св-ва частично . Это проявляется в уменьшении длины
этой связи (0,132 нм)по сравнению с длиной C N (0,147 нм). Частично
двоесвязный характер делает невозможным своб. вращение заместителей
вокруг нее. поэтому пептидная группировка является плоской и имеет обычно транс-конфигурацию
(ф-ла I). T. обр., остов пептидной цепи представляет собой ряд жестких плоскостей
с подвижным ("шарнирным") сочленением в месте, где расположены асимметрич.
С (в ф-ле I обозначены звездочкой).
В р-рах пептидов наблюдается
предпочтительное образование определенных конформе-ров. С удлинением цепи более
выраженную устойчивость приобретают (аналогично ) упорядоченные элементы
вторичной структуры (a
-спираль и b
-струк-тура). Образование вторичной
структуры особенно характерно для регулярных пептидов, в частности для полиаминокислот.
Свойства. Олигопептиды
по св-вам близки к , подобны . Олигопептиды представляют
собой, как правило, кристаллич. в-ва, разлагающиеся при нагр. до 200 300 0 C.
Они хорошо раств. в , разб. к-тах и , почти не раств. в орг. р-рителях.
Исключение Олигопептиды, построенные из остатков гидрофобных .
Олигопептиды обладают амфотерными
св-вами и, в зависимости от кислотности среды, могут существовать в форме ,
или . Осн. полосы поглощения в ИК спектре для группы NH
3300 и 3080 см -1 , для группы C=O 1660 см -1 . В УФ спектре
полоса поглощения пептидной группы находится в области 180-230 нм. Изоэлектрич.
точка (рI) пептидов колеблется в широких пределах и зависит от состава аминокислотных
остатков в . Величины рК а пептидов составляют для а-СООН
ок. 3, для a
-N
H 2 ок. 8.
Хим. св-ва олигопептидов определяются содержащимися в них функц. группами, а также особенностями . Их хим. превращения в значит. мере аналогичны соответствующим р-циям . Они дают положит. и . Дипептиды и их производные (особенно эфиры) легко циклизуются, превращаясь в . Под действием 5,7 н.
соляной к-ты пептиды гидролизуются
до в течение 24ч при 105 0 C.
Синтез.
Хим. синтез
пептидов заключается в создании между группой COOH одной
и NH 2 др. или пептида. В соответствии с этим различают
карбоксильную и аминную компоненты р-ции пептидного синтеза. Для проведения
целенаправленного контролируемого синтеза пептидов необходима предварит. временная
защита всех (или нек-рых) функц. групп, к-рые не участвуют в образовании , а также предварит. активация одной из компонент пептидного синтеза. После
окончания синтеза удаляют. При получении биологически активных
пептидов необходимое условие - предотвращение на всех этапах
пептидного синтеза.
Наиб. важные способы образования
при осуществлении р-ции в р-ре-методы активир. эфиров, кар-бодиимидный,
смешанных и азидный метод.
Метод активированных эфиров
основан на предварит. образовании сложноэфирного производного карбоксильной
компоненты путем введения в нее спиртового остатка, содержащего сильный электроноакцепторный
заместитель. В результате образуется высокореакционноспо-собный эфир, легко
подвергающийся под действием аминокомпоненты пептидного синтеза. В
качестве активир. эфиров при синтезе пептидов широко используют пента-фтор-, пентахлор-,
трихлор- и n-нитрофениловые и ряд др. эфиров защищенных и
пептидов.
Карбодиимидный метод образования
предусматривает использование в качестве конденсирующих
разл. замещенных . Особенно широкое применение при синтезе пептидов получил
дициклогексил-карбодиимид:

X и Y-соотв. N- и
С-защитные группы С этим конденсирующим можно осуществлять синтез
пептидов и в водных средах, т. к. скорости р-ций и промежуточно
образующейся О-ацилизомо-чевины (II) существенно различаются. При синтезе пептидов
находят также применение разл. водорастворимые карбодиими-ды (напр., N-диметиламинопропил-N"-этилкарбодиимид).
Метод смешанных
основан на предварит. активации карбоксильной компоненты пептидного синтеза
путем образования смешанного с карбоновой или неорг. к-той. Наиб.
часто используют алкиловые эфиры хлормуравьиной (хлоругольной) к-ты, особенно
этиловый и изобутиловый эфиры, напр.:

В - третичный
При синтезе пептидов по этому
методу весьма эффективны смешанные N-ациламинокислот и пивалиновой
(триметилуксусной) к-ты. Благодаря сильному положит. трет-бутилъной
группы электро-фильность карбоксильного С в остатке пивалиновой к-ты
существенно снижена, и это, наряду со стерич. препятствиями, подавляет нежелат.
побочную р-цию образования и своб. N-ациламинокислоты, к-рая осуществляется
по схеме:
В одном из вариантов метода
смешанных применяют в качестве конденсирующего агента 1-этоксикар-бонил-2-этокси-1,2-дигидрохинолин.
Это соед. легко образует с карбоксильной компонентой пептидного синтеза про-межут.
смешанный , быстро вступающий в р-цию , причем полностью
исключается нежелат. побочная р-ция.
Частный случай метода смешанных
- метод симметрич. , в к-ром используют
2 O. Их применение исключает возможность
или неправильного .
Азидный метод синтеза предусматривает
активацию карбоксильной компоненты предварит, превращением ее в N-замещенной
или пептида:

Ввиду нестойкости
их в своб. виде из р-ра, как правило, не выделяют. Если вместо для р-ции с гидразидом использовать алкиловые эфиры азотистой к-ты
(напр., трет-бутилнитрит), то азид-ную можно проводить
в орг. р-рителе; образующуюся HN 3 связывают третичными . Нередко
азидная осложняется нежелат. побочными р-циями (превращ. гидразида
не в , а в амид; р-ция
гидразида
с , ведущая к образованию 1,2-диацил-гидразина; промежут. образование
, к-рый в результате перегруппировки Курциуса может приводить к производному
или соответствующему и др.). Преимущества азидного метода-малая
степень , возможность применения и без защиты .
Для превращ. защищенных
пептидов в свободные используют спец. методы деблокирования, к-рые основаны на р-циях,
обеспечивающих отщепление разл. , гарантирующих сохранение всех
в . Примеры деблокирования: удаление оксикарбониль-ной
группы каталитич. при атм. и комнатной т-ре, отщепление
трет-бутилоксикарбонильной группы мягким , а также гидролитич.
отщепление трифторацетильной группы под действием разб. р-ров .
При синтезе биологически
активных пептидов важно, чтобы не происходила , к-рая может осуществляться
в результате обратимого отщепления H + от a
-атома С N-ациламинокислоты
или пептида. способствуют и к-ты, высокая т-ра и полярные
р-рители. Решающую роль играет , катализируемая , к-рая
может протекать по т. наз. азлактоновому механизму или через енолизацию по схеме:

Наиб. важные способы исключения
: 1) наращивание пептидной цепи в направлении от С-конца к N-концу
с применением N-защитных
групп типа ROC(O). 2) Активация N-защищенных пептидных фрагментов с С-концевы-ми
остатками или . 3) Использование азид-ного метода (при отсутствии
избытка третичного и поддержании низких т-р в реакц. среде). 4) Применение
активир. эфиров , к-рых протекает через переходное состояние,
стабилизир. водородными мостиками (напр., эфиров, образованных с N-гидроксипипери-дином
и 8-гидроксихинолином). 5) Использование карбоди-имидного метода с
N-гидроксисоед. или к-т Льюиса.
Наряду с синтезом пептидов в
р-рах, важное значение имеет синтез пептидов с применением нерастворимых .
Он включает пептидов (р-ция, или метод, Мэр-рифилда) и синтез
пептидов с использованием полимерных .
Стратегия твердофазного
пептидного синтеза предусматривает временное закрепление синтезируемой пептидной
цепи на нерастворимом полимерном и осуществляется по схеме:


Благодаря этому способу
удалось заменить весьма сложные и трудоемкие процедуры разделения и очистки
промежут. пептидов простыми операциями промывки и , а также свести
процесс пептидного синтеза к стандартной последовательности периодически повторяющихся
процедур, легко поддающихся автоматизации. Метод Меррифилда позволил существенно
ускорить процесс синтеза пептидов. На основе этой методологии созданы разл. типы автоматич.
синтезаторов пептидов.
Соединение высокопроизводит.
пептидов с разделяющими способностями препаративной ВЭЖХ обеспечивает
выход на качественно новый уровень хим. синтеза пептидов, что, в свою очередь, благотворно
влияет на развитие разл. областей , мол. биологии, фармакологии и медицины.
Стратегия синтеза пептидов с
применением полимерных предусматривает временное связывание с высокомол.
активир. карбоксильной компоненты или конденсирующего агента пептидного
синтеза. Преимущество этого метода: закрепленные на могут
вводиться в избытке, а отделение синтезированных пептидов от нерастворимых
не представляет затруднений.
Пример такого синтеза-пропускание аминокомпоненты в заданной последовательности через неск. колонок, в каждой из к-рых находится связанный с полимерным активир. эфир определенной